|
線虫の遺伝学入門 〜線虫を使うことで、どのようなことが調べられるのか知りたい方へ〜
(1) 順遺伝学(forward genetics)
大きな流れとして、順遺伝学は「スクリーニング→マッピング→原因遺伝子のクローニング(→その後の解析)」で構成されます[図1]。
スクリーニング(screening):
異常な線虫を作製する手段として、もっともよく用いられているのがEMS(Ethyl Methane Sulfonate) という薬剤です。薬剤処理を行った個体がP0世代であり、その子供がF1世代です。F1では卵/精子のいずれか片方由来の染色体のみに変異を有するヘテロ接合体 (heterozygote)の状態です。通常の劣性変異 (recessive mutation) の場合、野生型表現型
(wild type phenotype)を示します。さらにその子供のF2世代になりますと、変異のホモ接合体(homozygote) が出てくるので、様々な異常表現型が現れます。そのように多様な集団の中から、目的の表現型、たとえば動きの悪い個体や、見かけ上身体の形態がおかしくなっている個体を拾ってくることにより、スクリーニングを行います。
マッピング (mapping):
変異体を獲得した後、その異常の原因となる遺伝子が染色体上のどの場所に位置するかを決めることを遺伝学的マッピング
(genetic mapping)といいます。既に線虫のゲノム解読は全て終了していますので、染色体上の場所が詳細に決まれば、データベースを検索することで塩基配列もすぐにわかります。したがって近年は、遺伝学的マッピングを経て原因遺伝子のクローニングを行う、ポジショナルクローニング(positional cloning) が主流となっています。
線虫ゲノムは、5つの常染色体と1つの性染色体で構成されていますが、その中で。既知遺伝子などの遺伝学的マーカー
(genetic marker)を用いて原因となる遺伝子の位置を決めていきます。線虫で用いられるマーカー遺伝子としてDpyやBliなどが有名です。例えばDpyはふとくて短いコロコロとした形態ですし、Bliは表皮の一部がふくれあがり、その中に体液がたまるような異常を示しますので一目で遺伝子型が判別できます[図2]。

一方、近年ではSNPs(single nucleotide polymorphisms) をマーカーとして利用したマッピングがよく用いられています。SNPsは種内の個体間に存在する一塩基多型のことをいいます。多くのラボで用いている線虫C. elegansはイギリスのBristolで単離されたN2株に由来しています。それとは別にHawaiiで単離されたCB4856という株がありますが、見かけ上は全く差がありません。しかしN2とCB4856の系統間ではやはりゲノム配列が微妙に異なっており、その代表的なものがSNPsです[図3]。DpyやBliマーカーのように外見上異常はないので使いやすい上に、各染色体に無数に散在しているため、詳細にマッピングする用途に適しています。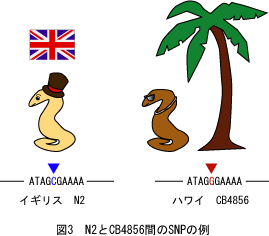
クローニング(cloning):
原因遺伝子の位置する領域が絞られてくると、具体的に候補を選んでいく作業に入ります。線虫のゲノム解読の過程で、コスミド(cosmid) の形で約40kbずつ断片化されたセットが作られました。多くの場合、まずこれらのコスミドを線虫の生殖腺の中へマイクロインジェクション=微小注入(microinjection) することで、表現型のレスキュー実験 (rescue
experiment) を行います。コスミドで異常表現型が回復すれば、個々の遺伝子のレスキュー能をみることで、原因遺伝子を決定することができます。
また、目的領域内に既存の変異体がいくつか存在する場合は、それらの変異体について自分の変異体と同じ表現型を有するのかをチェックすることで候補を絞り込むことができます。既存の変異体がない遺伝子であっても、最近は後述するRNAi(RNA interference) の技術を用いて遺伝子機能を阻害することが容易になりました。さらに既存変異体を用いて、相補性検定(complementation test) を行うことも、原因遺伝子の同定として以前からよく行われています。
(0)線虫の遺伝学トップページ
(2)逆遺伝学
(3)機能解析過程における遺伝学的方法論
|